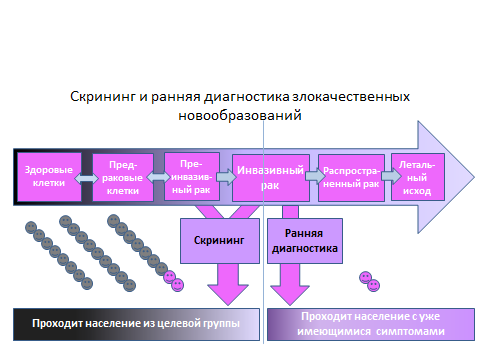
Что такое скрининг?
Под скринингом подразумевают применение различных методов исследования, позволяющих диагностировать опухоль на ранней стадии, когда еще нет симптомов болезни. Целью скрининга является раннее активное выявление бессимптомного рака и его лечение.
Злокачественная опухоль, диагностированная на ранней стадии, может быть излечена полностью. На более поздних стадиях, когда уже имеются симптомы заболевания и есть вероятность распространения опухоли — лечение заболевания усложняется.
Важно отметить, что прохождение скрининга не означает, что у обследуемого есть подозрение на рак.
Существуют различные виды скрининговых тестов.
Общий осмотр, онкоосмотр — программа обследования, предназначенная для проведения комплексного осмотра пациента на обширный круг возможных новообразований.
Лабораторные методы диагностики: физико-химические, биохимические и биологические методы исследования, с помощью которых можно анализировать состав и свойства биологических жидкостей и тканей человека, а также идентифицировать возбудителей заболеваний. Визуальная диагностика: Инструментальная диагностика позволяющая сделать снимок внутренних органов и организма в целом.
Генетические тесты: тесты, определяющие генные мутации (изменения), которые связаны с некоторыми видами рака.
Имеются ли у скрининга недостатки?
В качестве скринингового теста обычно используется простой и недорогой метод обследования, однако он, как правило, недостаточно точен, что при положительном его результате требует подтверждения более точным, но и более сложным методом. Это приводит к тому, что часть пациентов с положительным тестом («ложно-положительным») подвергаются ненужному дообследованию, в то время как часть пациентов с отрицательным («ложно-отрицательным») – не получают необходимого лечения.
Методы скрининга рака, эффективность которых доказана:
- маммографический скрининг рака молочной железы у женщин 50-69 лет;
- цитологический скрининг предрака и рака шейки матки;
- скрининг рака и предрака толстой кишки с помощью теста на скрытую кровь, колоноскопии, сигмоидоскопии;
Колоноскопия
Колоноскопия является методом скрининга при колоректальном раке, и дает возможность удаления новообразований толстой кишки (полипы) до их преобразования в злокачественную опухоль. С помощью колоноскопа врач-эндоскопист осматривает и оценивает состояние внутренней поверхности толстой кишки при помощи специального зонда, что дает возможность визуально диагностировать полипы и т.п., а также провести биопсию и удалить полипы размером в 1 мм и меньше. Сразу после удаления полипа можно определить, является ли он предраковым или нет. Эксперты рекомендуют, группам с среднем риском развития колоректального рака, проходить скрининг в возрасте от 50 до 75 лет. Повторная колоноскопия рекомендуется каждые 10 лет.
Низкодозовая спиральная компьютерная томография
Компьютерная томография – неинвазивный метод диагностики, позволяющий получить изображение исследуемого органа в трехмерном виде. Спиральная компьютерная томография используется для выявления рака легких на ранних стадиях как у курящих, так и у бросивших курить, хотя и не существует единого мнения о целесообразности проведения плановых КТ для выявления рака легких у курильщиков. Скрининг с использованием низкодозовой спиральной компьютерной томографии снижает риск смертности от рака легкого среди активных курильщиков возрасте от 55 до 74 года.
Маммография
Маммография – вид рентгенологического исследования, при котором выполняется рентгеновский снимок молочных желез в двух проекциях на специальном аппарате – маммографе. Маммография позволяет выявить очень маленькие опухоли молочной железы – до 0,5 см и даже меньше. При выявлении подозрительных изменений в молочной железе после этого исследования выполняется биопсия или удаление части железы. Скрининг рака молочной железы заключается в регулярном маммографическом обследовании у женщин 50-70 лет. Если у вас нет наследственной предрасположенности к раку молочной железы, и вы заинтересованы в профилактических обследованиях, вам рекомендуется проходить маммографию 1 раз в 2 года, начиная с 50 лет до 65-70 лет. У очень пожилых женщин (старше 70 лет) скрининг также не проводится, поскольку в этом возрасте очень часто выявляются так называемы «клинически незначимые» опухоли, т.е. опухоли, которые не приносят вреда в течение жизни женщины.
Пап-тест и тестирование вируса папилломы человека (ВПЧ)
Мазок на цитологию или Пап-тест — процедура для сбора клеток с поверхности шейки матки и влагалища. В мазке оцениваются размеры, формы, количество и характер расположения клеток, что позволяет диагностировать фоновые, предраковые и раковые заболевания шейки матки. Тест на ВПЧ используется для проверки ДНК и РНК на наличие онкогенных типов вируса. С помощью мазка на цитологию и теста на ВПЧ проводится раз в 5 лет от 30. Мазок на цитологию и тест на ВПЧ уменьшают заболеваемость и смертность от рака шейки матки.
Другие методы скрининга.
Анализ крови на альфа-фетопротеин
Этот тест используется вместе с ультразвуковым исследованием печени для обнаружения рака печени у групп с высоким риском заболевания.
Магнитно- резонансная томография молочной железы является диагностическим инструментом при обследовании женщин из группы высокого риска рака молочной железы, особенно на фоне отягощенного семейного анамнеза. Отягощенный семейный анамнез подразумевает развитие рака молочной железы у матери или сестры пациентки в возрасте до 50 лет. При обычной маммографии для получения изображения тканей молочной железы применяются рентгеновские лучи, а при магнитно-резонансной – радиоволны.
Анализ на CA-125
Этот анализ крови, который часто проводится вместе с трансвагинальным ультразвуковым исследованием применятся для раннего выявления рака яичников, особенно у женщин с повышенным риском заболевания. Тест так же используется для оценки повторного развития рака, ранее диагностированных с раком яичников.
Самообследование молочной железы
Самообследование следует проводить регулярно раз в месяц в определённый день. Для половозрелой женщины наиболее подходящим временем является седьмой день после начала менструации. Контроль молочных желёз должны проводить все женщины в возрасте более 20-ти лет для того, чтобы оценить обычное состояние молочных желёз и своевременно обнаружить происходящие в них изменения. Рак груди можно обнаружить при ощупывании если диаметр опухоли более 1 см.
Клиническое исследование молочных желез проводится врачом- маммологом.
ПСА тест
Анализ крови, который проводится вместе с инструментальным ректальным обследованием, позволяет обнаружить рак предстательной железы на ранней стадии. Эксперты не рекомендуют стандартное тестирование ПСА для всех мужчин, поскольку исследования показали, что он практически не влияет на смертность от рака предстательной железы и приводит к гипердиагностике. Простат-специфический антиген, или ПСА, представляет собой белок, продуцируемый клетками предстательной железы. В дополнение к раку предстательной железы ряд доброкачественных (не раковых) состояний может привести к повышению уровня ПСА у мужчин. Наиболее частыми доброкачественными состояниями простаты, которые вызывают повышение уровня ПСА, являются простатит (воспаление предстательной железы) и доброкачественная гиперплазия предстательной железы (ДГПЖ) (увеличение предстательной железы).
Визуальный осмотр кожи
Лучший способ начать диагностику рака кожи — ежемесячно самостоятельно осматривать собственную кожу. Нужно следить за изменениями, в частности за появлением необычных родинок, которые изменяют форму, размер, высоту или цвет либо имеют неровные края. Обнаружение подозрительных поражений означает положительный скрининговый тест, после которого необходимо выполнить кожную биопсию. Рекомендуется тщательный осмотр покровов кожи 1 раз в месяц.
Трансвагинальное УЗИ
Трансвагинальное УЗИ (УЗИ малого таза) – этот метод исследования женских половых органов (в первую очередь матки и яичников) с помощью ультразвука – безболезненное и безопасное обследование. С помощью УЗИ возможна диагностика многих гинекологических заболеваний, в том числе рака яичников или матки. Обычно это исследование проводится в первой фазу менструального цикла (на 5-7 день от начала менструации).
Скриниги которые проводится в РК
Маммографический скрининг — Интервал: 1 раз в 2 года
Целевая группа: женщины в возрасте 40-70 лет не состоящие на диспансерном учете по поводу злокачественного образования молочной железы.
Что нужно знать перед обследованием!!!
- Иметь при себе сухие салфетки или платочек (так как, многие женщины потеют, а влага может исказить снимки и исследование будет некачественным).
- Исследование проводится на 5 – 10 день после начала менструации.
- Процедура обследования может быть слегка болезненной, но абсолютно безопасной и без последствий.
Скрининг рака шейки матки — Интервал: 1 раз в 4 года.
Целевая группа: женщины в возрасте 30-70 лет, не состоящие на учете по поводу злокачественного новообразования шейки матки
Что нужно знать перед обследованием!!!
- За 2 дня до исследования не должно быть половых контактов.
- За 2 дня до исследования не должно быть никаких влагалищных манипуляций (спринцевание, ванночки, тампоны и т.д.).
- Во время взятия материала не должно быть менструации.
Колоректальный скрининг — Интервал: 1 раз в 2 года
Целевая группа: мужчины и женщины в возрасте 50-70 лет, не состоящие на диспансерном учете по поводу полипоза и злокачесвенного новообразования толстой кишки.
Что нужно знать перед обследованием!!!
- Пациенту на руки выдаётся иммунохимический экспресс-тест.
- Иммунохимическое исследование кала на скрытую кровь проводится экспресс-методом самим пациентом.
- Подробно объясняется, как использовать экспресс-тест.
Оценка теста проводится только медицинским работником!
